Elektrolyse einer Metallsalzlösung
Zielsetzung: Das Arbeitsblatt dient dem Verständnis der chemischen Speicherung elektrischer Energie. Ziel ist es, die chemischen Vorgänge bei der Ladung und Entladung eines Akkumulators (Akku) nachzuvollziehen und die Elektrolyse von der galvanischen Zelle abzugrenzen.
Inhalte und Methoden: Das Material vermittelt die theoretischen und praktischen Grundlagen der Elektrolyse, um das Prinzip der stofflichen Energiespeicherung für die Lernenden erschließbar zu machen. Methodisch führt der Weg von der alltagsnahen Hypothesenbildung über das eigenständige Experimentieren unter Sicherheitsaspekten bis hin zur fachsprachlichen Deutung und formalen Analyse der Redoxreaktionen. Abschließend festigen die Schüler:innen ihr Verständnis durch einen systematischen Vergleich mit galvanischen Zellen und den Transfer auf die Funktionsweise moderner Akkumulatoren.
Kompetenzen:
- Fachwissen Chemie: Verständnis von Redoxreaktionen, Elektrolyseprozessen und der Umwandlung von elektrischer in chemische Energie
- Erkenntnisgewinnung: Planung, Durchführung und Auswertung chemischer Experimente unter Einhaltung von Sicherheitsvorschriften
- Modellkompetenz: Vergleich und Abgrenzung verschiedener elektrochemischer Modelle (galvanische Zelle vs. Elektrolyse)
- Transferfähigkeit: Anwendung theoretischer Konzepte auf reale Energiespeichersysteme (Akkumulatoren)
Zielgruppe und Niveau: Ab der 10. Klasse
BNE:
- SDG 12 (Nachhaltiger Konsum und Produktion): Bewusstsein für die Funktionsweise und den effizienten Einsatz von Akkumulatoren zur Ressourcenschonung.
Hinweis: Damit dieses Arbeitsblatt ohne Probleme ausgefüllt werden kann, muss das Daniel-Element besprochen worden sein.
Hinweis: Besprich vor der Durchführung des Experiments mit deinen Schüler:innen die notwendigen Sicherheitsregeln!
57 other teachers use this template
Target group and level
ab Klasse 10
Subjects
Elektrolyse einer Metallsalzlösung
Wie funktioniert ein Akku? - Gruppenarbeit
- Ihr erhaltet von eurer Lehrkraft einen echten Akku, zum Beispiel einen Handy- oder Fahrradakku. Betrachtet den Akku genau und überlegt, wofür er im Alltag verwendet wird.
- Ihr arbeitet nun in Kleingruppen mit 3–4 Personen und beantwortet die Frage: Wie kann elektrische Energie gespeichert werden, obwohl Elektronen nicht einfach "aufbewahrt" werden können?
- In eurer Gruppe sammelt ihr Vermutungen, wie ein Akku funktionieren könnte. Verwendet dabei keine Fachbegriffe, sondern formuliert eure Ideen in eigenen Worten. Haltet eure Ergebnisse fest.
Leitfragen für eure Gruppe
- Was wird eurer Meinung nach in einem Akku gespeichert?
- Welche Rolle könnten Stoffe oder Flüssigkeiten im Inneren eines Akkus spielen?
- Welche Energieform liegt vor dem Laden und welche nach dem Laden vor?
Wie kann elektrische Energie gespeichert werden, obwohl Elektronen nicht einfach ‚aufbewahrt‘ werden können?
Versuchsaufbau - Einzelarbeit
Schau dir das Bild an und notiere alle Materialien, die du bereits kennst.

Materialien für eine Elektrolyse
Versuchaufbau - Einzelarbeit
Lies dir die Versuchsdurchführung durch und zeichne das Experiment auf.
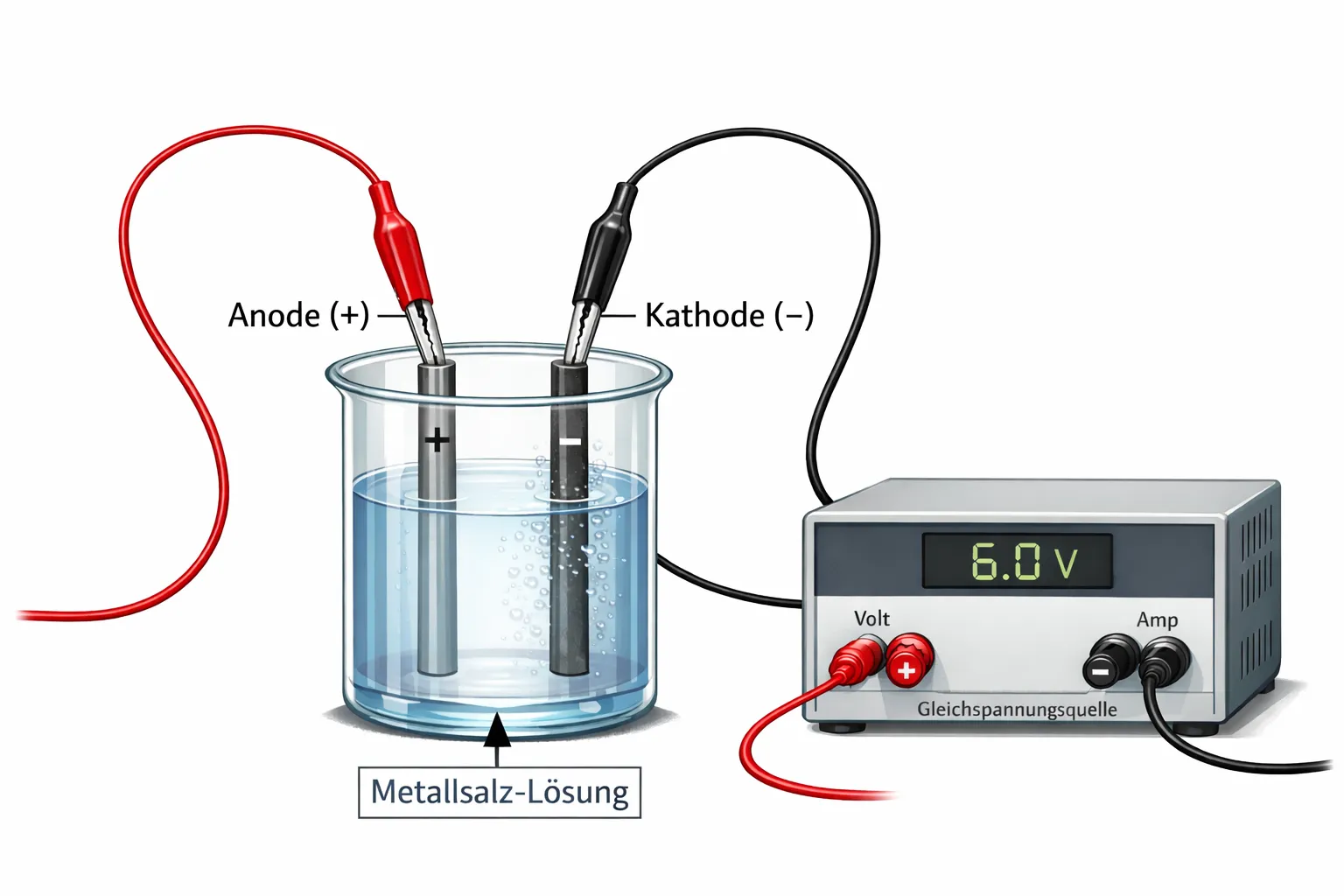
Versuchsaufbau zur Elektrolyse einer Kupfersulfat-Lösung
- Eine Schutzbrille wird aufgesetzt, um die Augen zu schützen.
- Die Kupfersulfat-Lösung wird aus der Flasche in den durchsichtigen Messbecher gegossen.
- Die beiden Graphitstäbe dienen als Elektroden und werden so in die Lösung gestellt, dass sie sich nicht berühren.
- Die Elektrodenklemmen werden jeweils an einen Graphitstab befestigt.
- Die roten und schwarzen Kabel mit Krokodilklemmen verbinden die Elektrodenklemmen mit den entsprechenden Polen der Gleichspannungsquelle.
- Die Gleichspannungsquelle wird eingeschaltet und auf 6,0 Volt eingestellt.
- Der Stromkreis ist nun geschlossen und die Elektrolyse kann beobachtet werden.
Lade Zeichenfeld...
Versuchsdurchführung - Gruppenarbeit
Ihr erhaltet nun die Materialien und führt das Experiment in kleinen Gruppen durch.
Bevor ihr mit dem Experiment beginnt, notiert eure Hypothesen: Überlegt, was eurer Meinung nach passieren wird, und begründet eure Vermutungen. Während und nach dem Experiment haltet ihr eure Beobachtungen schriftlich fest.
Besprecht anschließend in der Gruppe, wie ihr das Ergebnis erklären könnt, und formuliert gemeinsam eine passende Deutung.
Zur Unterstützung nutzt ihr eure Skizze oder die Abbildung.
Hypothese
| Bereich | Beobachtung | Deutung (erste Vermutung) |
|---|---|---|
| Kathode | ||
| Anode | ||
| Lösung |
Deutung
Auswertung - Partnerarbeit
- Tragt eure Ergebnisse in die Tabelle ein.
- Formuliert die Oxidations- und Reduktionsreaktionen.
Zusatzaufgabe
- Erklärt, warum bei diesem Experiment elektrische Energie zugeführt werden muss.
Vergleich: Elektrolyse ↔ galvanische Zelle
Vergleicht die Elektrolyse mit der galvanischen Zelle.
Füllt dazu die Tabelle vollständig aus und achtet auf die Gemeinsamkeiten und Unterschiede.
| Merkmal | Elektrolyse | Galvanische Zelle |
|---|---|---|
| Energieumwandlung | ||
| Freiwilligkeit | ||
| Polung der Elektroden | ||
| Technisches Beispiel |
Transfer: Elektrochemischer Energiespeicher
Erkläre, warum ein Akkumulator sowohl als Elektrolysezelle als auch als galvanische Zelle betrachtet werden kann.
Lösung für die Lehrkraft
| Bereich | Beobachtung | Deutung (erste Vermutung) |
|---|---|---|
| Kathode | Es bildet sich eine rötliche Kupferschicht. | Reduktion der Kupfer(II)-Ionen zu elementarem Kupfer. |
| Anode | Gasblasen entstehen. | Oxidation von Wasser zu Sauerstoffgas. |
| Lösung | Veränderung der Konzentration der Kupferionen. | Verbrauch der Kupferionen während der Elektrolyse. |
| Wanderung von… | Begründung | |
|---|---|---|
| Kathode | Kupfer(II)-Ionen (Cu²⁺) | Reduktion von Cu²⁺ zu elementarem Kupfer durch Aufnahme von Elektronen |
| Anode | Wassermoleküle (H₂O) | Oxidation von H₂O zu Sauerstoffgas und Wasserstoffionen durch Abgabe von Elektronen |
| Merkmal | Elektrolyse | Galvanische Zelle |
|---|---|---|
| Energieumwandlung | Elektrische Energie wird in chemische Energie umgewandelt. | Chemische Energie wird in elektrische Energie umgewandelt. |
| Freiwilligkeit | Nicht freiwillig; erfordert eine externe Spannungsquelle. | Freiwillig; Reaktion läuft spontan ab. |
| Polung der Elektroden | Kathode ist der Minuspol, Anode ist der Pluspol. | Kathode ist der Pluspol, Anode ist der Minuspol. |
| Technisches Beispiel | Elektrolyse von Kupfersulfat zur Kupfergewinnung. | Batterien und Akkumulatoren. |