Gemische und Reinstoffe
Zielsetzung: Das Arbeitsblatt zielt darauf ab, den Lernenden die fundamentalen chemischen Konzepte von Gemischen und Reinstoffen zu vermitteln. Es soll das theoretische Wissen durch zwei praktische Experimente verankern, bei denen sie lernen, die Stoffe anhand ihrer Eigenschaften (Löslichkeit, Siedepunkt, Trennbarkeit) zu unterscheiden.
Inhalte und Methoden: Ein Sachtext führt in die "bunte Welt der Gemische und Reinstoffe" ein. Der Kern des Arbeitsblatts sind zwei Experimente zur Erkennung von Reinstoffen und Gemischen. Die Lernenden sollen Gemische herstellen und deren Löslichkeit beobachten. Anschließend führen sie eine Filtration durch und sollen optional den Siedepunkt messen.
Kompetenzen:
- Chemisches Fachwissen: Definition und Unterscheidung von Gemischen, Reinstoffen und Verbindungen.
- Experimentelle Fähigkeiten: Selbstständiges Planen und Durchführen eines Experiments zur Stofftrennung.
- Analytisches Denken: Interpretation von Beobachtungen (Löslichkeit, Filtration) zur Unterscheidung von Stoffen.
- Sicherheitsbewusstsein: Einhaltung von Sicherheitsregeln im Labor.
Zielgruppe und Niveau: Das Arbeitsblatt richtet sich an Schüler:innen im Chemieunterricht der Sekundarstufe. Es verbindet theoretisches Wissen mit grundlegenden praktischen Experimenten.
80 other teachers use this template
Target group and level
Schüler:innen im Chemieunterricht der Sekundarstufe
Subjects
Gemische und Reinstoffe
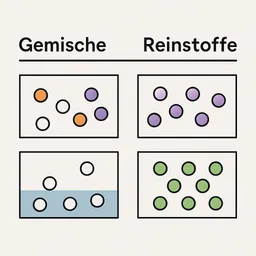
Die bunte Welt der Gemische und Reinstoffe
In der Chemie unterscheidet man zwischen Gemischen und Reinstoffen. Gemische, wie Luft, bestehen aus mehreren Stoffen, die man mit einfachen, physikalischen Methoden wieder trennen kann. Die Luft ist ein gutes Beispiel: Sie enthält vor allem Stickstoff, Sauerstoff und ein wenig Kohlenstoffdioxid. Jeder dieser Stoffe hat typische Eigenschaften. Stickstoff ist farb- und geruchlos, Sauerstoff lässt Kerzen heller brennen, und Kohlenstoffdioxid sprudelt in Limonade.
Reinstoffe hingegen bestehen nur aus einer einzigen Sorte Teilchen und haben immer dieselben Eigenschaften. Wasser ist ein solcher Reinstoff: Es sieht überall gleich aus und hat immer denselben Siedepunkt. Auch Metalle wie Eisen, Kupfer, Silber oder Magnesium sind Reinstoffe, genauso wie die Gase Wasserstoff und Chlor. Jedes dieser Elemente zeigt klare, typische Merkmale: Eisen ist fest und magnetisch, Kupfer glänzt rötlich, Silber ist besonders glänzend und Magnesium brennt mit einer hellen Flamme.
Manchmal verbinden sich Reinstoffe zu neuen Stoffen, den sogenannten Verbindungen. Beispiele sind Natriumchlorid (Kochsalz), das aus Natrium und Chlor besteht, oder Magnesiumoxid, das entsteht, wenn Magnesium mit Sauerstoff reagiert. Auch Flüssigkeiten wie Salzsäure und feste Stoffe wie Natriumhydroxid sind Verbindungen mit eigenen Eigenschaften. Salzsäure ist zum Beispiel eine farblose, stechend riechende Flüssigkeit, die Metalle auflösen kann.
Um herauszufinden, ob ein Stoff ein Gemisch oder ein Reinstoff ist, hilft die Identifizierung durch Eigenschaften: Man schaut auf Schmelzpunkt, Siedepunkt, Farbe, Geruch oder die elektrische Leitfähigkeit. Reinstoffe zeigen immer dieselben Werte, Gemische können sich unterscheiden.
So entdeckt man in der Chemie eine bunte Vielfalt an Stoffen – jeder mit seinen eigenen, spannenden Eigenschaften!
Lies dir den Text auf der vorherigen Seite durch und schreibe die wichtigsten Informationen daraus auf.
Verbinde die Fachbegriffe auf der linken Seite mit den Definitionen auf der rechten Seite.
Arbeitsauftrag
Du erhältst nun von deiner Lehrkraft eine Probe. Deine Aufgabe ist es, eigenständig herauszufinden, ob es sich bei der Probe um ein Gemisch oder einen Reinstoff handelt.
Experiment 1: Nachweis von Reinstoffen und Gemischen durch Filtration
Sicherheitshinweise:
- Trage stets Schutzbrille und Handschuhe.
- Gehe vorsichtig mit heißen Geräten um, um Verbrennungen zu vermeiden.
- Achte darauf, Flüssigkeiten sicher zu handhaben und Verschütten zu vermeiden.
Materialien:
- Reines Wasser (H₂O)
- Salz
- Zucker
- Drei transparente Bechergläser
- Löffel
- Messbecher
- Filterpapier
- Trichter
Durchführung:
Lösung herstellen:
- Gib einen Teelöffel Salz in ein Becherglas mit 100 ml Wasser und rühre, bis es sich vollständig auflöst.
- In ein zweites Becherglas gib einen Teelöffel Zucker in 100 ml Wasser und rühre ebenfalls um, bis es sich vollständig auflöst.
- Fülle in das dritte Becherglas 100 ml reines Wasser.
Filtration durchführen:
- Setze einen Trichter mit Filterpapier auf ein leeres Becherglas.
- Gieße die Salzlösung langsam durch das Filterpapier und beobachte, ob sich Rückstände im Filterpapier bilden.
- Wiederhole den Vorgang mit der Zuckerlösung und anschließend mit dem reinen Wasser.
Dauer:
- Das Experiment dauert etwa 15 Minuten.
Experiment 2: Untersuchung des Siedepunktes von Wasser und Salzlösung
Sicherheitshinweise:
- Trage stets Schutzbrille und Handschuhe.
- Gehe vorsichtig mit heißen Geräten und kochendem Wasser um, um Verbrennungen zu vermeiden.
- Halte das Thermometer von der Heizquelle fern, wenn es nicht temperaturbeständig ist.
Materialien:
- Reines Wasser (H₂O)
- Salz
- Zwei kleine Kochtöpfe oder hitzebeständige Bechergläser
- Herdplatte oder Heizplatte
- Thermometer
- Löffel
Durchführung:
Vorbereitung:
- Fülle 100 ml reines Wasser in den ersten Topf oder ein Becherglas.
- Gib in den zweiten Topf oder ein Becherglas 100 ml Wasser und löse darin einen Teelöffel Salz vollständig auf.
Erhitzen und Beobachten:
- Erhitze beide Gefäße gleichzeitig auf der Herdplatte.
- Miss mit dem Thermometer regelmäßig die Temperatur beider Flüssigkeiten und notiere die Temperatur, wenn das Wasser zu kochen beginnt (Bläschenbildung).
Dauer:
- Das Experiment dauert etwa 15 Minuten.
Beide Experimente zusammen dauern etwa 30 Minuten.
✒️ Schreibe deine Beobachtungen zu den Experimenten auf.
Aufgabe 1: Filtration und Nachweis von Reinstoffen und Gemischen
a) Beschreibe den Unterschied zwischen einem Reinstoff und einem Gemisch. Verwende die Ergebnisse des Filtrationsexperiments, um deine Erklärung zu unterstützen.
b) Welche Beobachtungen hast du bei der Filtration der Salzlösung, der Zuckerlösung und des reinen Wassers gemacht? Begründe, warum sich bei einigen Lösungen Rückstände im Filterpapier gebildet haben könnten oder auch nicht.
Aufgabe 2: Untersuchung des Siedepunktes
a) Erkläre den Einfluss von gelösten Stoffen auf den Siedepunkt einer Flüssigkeit. Verwende die Beobachtungen aus dem Experiment mit der Salzlösung und dem reinen Wasser, um deine Erklärung zu untermauern.
b) Welche Temperatur hast du notiert, als das reine Wasser und die Salzlösung jeweils zu kochen begonnen haben? Vergleiche die Siedepunkte und erkläre, warum sie sich unterscheiden könnten.